概念:概括地說(shuō),轉(zhuǎn)染是使用非病毒感染的手段人工引入核酸(DNA或RNA)進(jìn)入細(xì)胞的過(guò)程。轉(zhuǎn)染的目的是產(chǎn)生重組蛋白,或特異性增強(qiáng)或抑制轉(zhuǎn)染細(xì)胞中的基因表達(dá)。
轉(zhuǎn)染的類型
根據(jù)導(dǎo)入的核酸存在于宿主細(xì)胞的時(shí)間長(zhǎng)短,可以分為瞬轉(zhuǎn)和穩(wěn)轉(zhuǎn)。根據(jù)轉(zhuǎn)染方式可以分為化學(xué),生物,物理方法。
瞬轉(zhuǎn):因?yàn)閷?dǎo)入的核酸沒(méi)有整合到宿主細(xì)胞基因組,因此它只會(huì)短暫地存在于宿主細(xì)胞中,不會(huì)隨著細(xì)胞的分裂而進(jìn)入到子代細(xì)胞中。然而,導(dǎo)入的遺傳物質(zhì)的高拷貝數(shù)導(dǎo)致其在細(xì)胞內(nèi)的蛋白質(zhì)表達(dá)水平較高。根據(jù)所使用的載體的不同,瞬轉(zhuǎn)通常可以1至7天內(nèi)進(jìn)行基因檢測(cè),但是瞬時(shí)轉(zhuǎn)染的細(xì)胞通常在轉(zhuǎn)染后24-96小時(shí)收獲。當(dāng)使用超螺旋質(zhì)粒DNA時(shí),瞬時(shí)轉(zhuǎn)染的效果最好,推測(cè)是由于超螺旋質(zhì)粒DNA能更有效地被細(xì)胞攝取。
穩(wěn)轉(zhuǎn):外源DNA整合到細(xì)胞基因組中或作為附加體質(zhì)粒保留在細(xì)胞中。與瞬時(shí)轉(zhuǎn)染不同,穩(wěn)定轉(zhuǎn)染允許外源DNA在轉(zhuǎn)染的細(xì)胞及其后代中的長(zhǎng)期維持。然而,通常是將單拷貝或幾個(gè)拷貝的外源DNA整合到穩(wěn)定轉(zhuǎn)染的細(xì)胞的基因組中,因此,其表達(dá)水平一般低于瞬時(shí)轉(zhuǎn)染的表達(dá)水平。
由于穩(wěn)轉(zhuǎn)效率較低,因此選用有效地轉(zhuǎn)染策略和篩選方法很重要。其中比較可靠地篩選方法是在DNA載體中包含選擇性標(biāo)記,然后在細(xì)胞轉(zhuǎn)染短暫性恢復(fù)后進(jìn)行適當(dāng)?shù)剡x擇性加壓。盡管相對(duì)于超螺旋DNA,線性DNA被細(xì)胞攝取的效率較低,但其能最有效地整合到宿主基因組中。
目前,由于各種轉(zhuǎn)染試劑的發(fā)明,哺乳動(dòng)物細(xì)胞的瞬時(shí)轉(zhuǎn)染已經(jīng)用于生產(chǎn)具有適當(dāng)折疊和翻譯后修飾的重組蛋白。但表達(dá)mg/L-g/L的重組蛋白主要依賴于穩(wěn)定細(xì)胞系的產(chǎn)生。
瞬轉(zhuǎn)和穩(wěn)轉(zhuǎn)的比較
| 瞬轉(zhuǎn) | 穩(wěn)轉(zhuǎn) |
導(dǎo)入的DNA沒(méi)有整合到基因組中,而是保留在細(xì)胞核上 | 導(dǎo)入的DNA整合到基因組中 |
導(dǎo)入的遺傳物質(zhì)不傳遞到子代; 遺傳改變只是暫時(shí)的 | 導(dǎo)入的遺傳物質(zhì)能夠代代相傳;遺傳改變是永久的 |
不需要選擇性篩選 | 需要選擇性篩選出穩(wěn)定轉(zhuǎn)染的細(xì)胞 |
DNA載體和RNA都可用于瞬時(shí)轉(zhuǎn)染 | 只有DNA載體可用于穩(wěn)定轉(zhuǎn)染;RNA本身不能穩(wěn)定地導(dǎo)入細(xì)胞中 |
導(dǎo)入的遺傳物質(zhì)的高拷貝數(shù)導(dǎo)致高水平的蛋白質(zhì)表達(dá)。 | 單拷貝數(shù)或低拷貝數(shù)的穩(wěn)定整合的DNA導(dǎo)致較低水平的蛋白質(zhì)表達(dá)。 |
通常在轉(zhuǎn)染后24-96小時(shí)內(nèi)收獲細(xì)胞。 | 需要2-3周的時(shí)間篩選出穩(wěn)定轉(zhuǎn)染的細(xì)胞克隆。 |
通常不適合使用具有誘導(dǎo)型啟動(dòng)子的載體的研究。 | 適用于使用帶有誘導(dǎo)型啟動(dòng)子的載體的研究。 |
轉(zhuǎn)染方式
細(xì)胞由帶負(fù)電荷的磷脂雙分子層構(gòu)成,這對(duì)大分子物質(zhì)來(lái)說(shuō)是個(gè)不可透過(guò)的屏障,比如DNA和RNA的磷酸骨架,其也帶負(fù)電荷。為了使核酸穿過(guò)細(xì)胞膜,研究人員開(kāi)發(fā)了多種技術(shù),大致分為三類:化學(xué)方法---利用載體分子包被核酸使其呈現(xiàn)中性電荷或正電荷。生物方法---利用基因工程病毒轉(zhuǎn)染非病毒基因到細(xì)胞中。物理方法---在細(xì)胞膜表面產(chǎn)生一個(gè)瞬時(shí)的孔從而導(dǎo)入DNA。然而,沒(méi)有一種方法適用于所有的細(xì)胞和實(shí)驗(yàn),理想的方法應(yīng)根據(jù)您的細(xì)胞類型和實(shí)驗(yàn)需要進(jìn)行選擇,理想的方法應(yīng)具有高轉(zhuǎn)染效率,低細(xì)胞毒性和對(duì)正常生理學(xué)的影響最小,并且易于使用和可重復(fù)性等特點(diǎn)。
化學(xué)轉(zhuǎn)染方法 | ||
技術(shù) | 優(yōu)點(diǎn) | 缺點(diǎn) |
陽(yáng)離子脂質(zhì)體 |
|
|
磷酸鈣共沉淀 |
|
|
葡聚糖 |
|
|
其他陽(yáng)離子聚合物 |
|
|
生物轉(zhuǎn)染方法 | ||
病毒轉(zhuǎn)染 |
|
|
物理轉(zhuǎn)染方法 | ||
電轉(zhuǎn) |
|
|
生物傳遞粒子傳遞(粒子轟擊) |
|
|
顯微注射 |
|
|
激光介導(dǎo)的轉(zhuǎn)染(光轉(zhuǎn)染) |
|
|
陽(yáng)離子脂質(zhì)體介導(dǎo)的轉(zhuǎn)染
原理:陽(yáng)離子脂質(zhì)體介導(dǎo)的轉(zhuǎn)染是目前最常用的轉(zhuǎn)染方式之一。陽(yáng)離子脂質(zhì)的基本結(jié)構(gòu)由帶正電荷的頭基和一個(gè)或兩個(gè)烴鏈組成,帶正電荷的頭基與帶負(fù)電荷的核酸通過(guò)靜電作用形成復(fù)合物,經(jīng)細(xì)胞的內(nèi)吞作用進(jìn)入細(xì)胞。LifeTechnologies?提供了廣泛的陽(yáng)離子脂質(zhì)介導(dǎo)的轉(zhuǎn)染試劑,用于有效地將DNA,RNA,siRNA或寡核苷酸引入廣泛的細(xì)胞類型,包括Lipofectamine?3000試劑。當(dāng)選擇轉(zhuǎn)染試劑時(shí),您必須考慮您希望導(dǎo)入(DNA,RNA或蛋白質(zhì))的有效載荷以及要轉(zhuǎn)染的細(xì)胞類型,因?yàn)檗D(zhuǎn)染試劑的選擇強(qiáng)烈影響轉(zhuǎn)染結(jié)果。
實(shí)驗(yàn)步驟:將DNA,RNA,siRNA或寡核苷酸和轉(zhuǎn)染試劑分別在不同的管中稀釋→將兩者混合形成混合物→將形成的混合物加入細(xì)胞中,脂質(zhì)體的正電荷有助于幫助復(fù)合物粘附到細(xì)胞膜上→復(fù)合物經(jīng)細(xì)胞內(nèi)吞作用進(jìn)入細(xì)胞→檢測(cè)基因表達(dá)或沉默情況。
磷酸鈣共沉淀
原理:將DNA與氯化鈣在磷酸緩沖鹽水中混合形成磷酸鈣-DNA沉淀物,然后將其分散在培養(yǎng)的細(xì)胞上,磷酸鈣促進(jìn)共沉淀物中的縮合DNA與細(xì)胞表面的結(jié)合,DNA通過(guò)內(nèi)吞作用進(jìn)入細(xì)胞。
實(shí)驗(yàn)步驟:將氯化鈣和DNA混合,以可控的方式加入磷酸緩沖液。→在室溫下孵育,以形成極細(xì),可溶的共沉淀微粒→將磷酸鈣-DNA沉淀物加入細(xì)胞中,后者能黏附到細(xì)胞膜表面→共沉淀物經(jīng)細(xì)胞內(nèi)吞作用進(jìn)入細(xì)胞→檢測(cè)基因表達(dá)或沉默情況。
病毒轉(zhuǎn)染
原理:對(duì)于用脂質(zhì)體不能實(shí)現(xiàn)轉(zhuǎn)染的細(xì)胞,可以采用病毒轉(zhuǎn)染。腺病毒,逆轉(zhuǎn)錄病毒和慢病毒載體已廣泛用于哺乳動(dòng)物細(xì)胞體內(nèi)外的基因轉(zhuǎn)染。
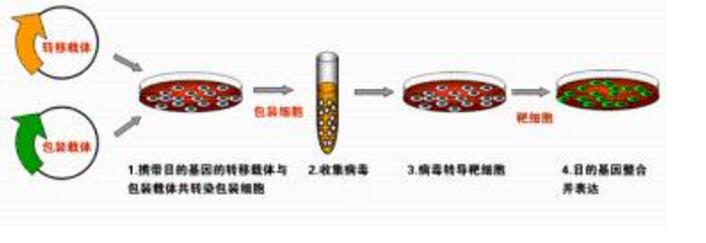
實(shí)驗(yàn)步驟:通過(guò)基因克隆方法獲得重組病毒表達(dá)載體→轉(zhuǎn)染包裝細(xì)胞系,擴(kuò)增并分離得到重組病毒顆粒→純化并滴定病毒液→轉(zhuǎn)導(dǎo)目的細(xì)胞(含有病毒特異性的受體)→從培養(yǎng)基中移除病毒→檢測(cè)基因表達(dá)或沉默情況。
電轉(zhuǎn)
原理:利用電脈沖在細(xì)胞膜上形成暫時(shí)的孔使核酸物質(zhì)能穿過(guò)孔進(jìn)入細(xì)胞。
實(shí)驗(yàn)步驟:利用電轉(zhuǎn)緩沖液重懸細(xì)胞→對(duì)含有核酸,緩沖液,細(xì)胞的混合物給予合適的電脈沖→電脈沖在細(xì)胞膜上形成電勢(shì)差,誘導(dǎo)產(chǎn)生暫時(shí)的孔使核酸進(jìn)入細(xì)胞→將細(xì)胞返回到生長(zhǎng)培養(yǎng)基中,使其慢慢恢復(fù)→檢測(cè)基因表達(dá)或沉默情況。
